タンパク質とは何だろうか
タンパク質は、生物の体の部品のようなものである。
人間の手も足も、体のあらゆる部位は、細胞で構成されている。
その細胞の重要なパーツとして、タンパク質は使われている。
生きるために不可欠な栄養素。
とにかく、我々が食べ物と呼ぶものは、ほとんど全てにタンパク質が含まれている。
ではタンパク質とは何だろうか。
タンパク質、たんぱく質、蛋白質
タンパク質は、漢字で「蛋白質」と書く。
英語では「protein」。
基本的には、カタカナで書くのが一般的なタンパク質だが、栄養学の分野などでは、ひらがなで「たんぱく質」と書かれる場合もある。
英語のproteinは、ギリシャ語の「proteios」に由来するとされる。
proteiosの意味は「第一」である。
proteinという言葉が、科学論文で最初に使用されたのは1838年。
その論文を書いたのはオランダのモルダーで、彼にその名前を提案したのは、スウェーデンのベルセリウスだという。
日本語の蛋白質の蛋白とは、卵の白身の事とされる。
この言葉は、ドイツ語のEiweiβ(タンパク質)という語に、卵白という意味もある事から、そこから訳出されたものと考えられる。
アミノ酸とは何か
タンパク質というのを、さらに構成しているのが「アミノ酸」という分子である。
つまり、生物の構成部品は、アミノ酸とも言える。
しかし、そんなふうに考えていったら、結局我々 という存在そのものを構成しているのは、実質的には素粒子である。
 「量子論」波動で揺らぐ現実。プランクからシュレーディンガーへ
「量子論」波動で揺らぐ現実。プランクからシュレーディンガーへ
アミノ酸は基本的に、炭素(C)、水素(H)と「アミノ基(NH2)」、「カルボキシ基(COOH)」を主鎖として、そこに様々な側鎖かつく。
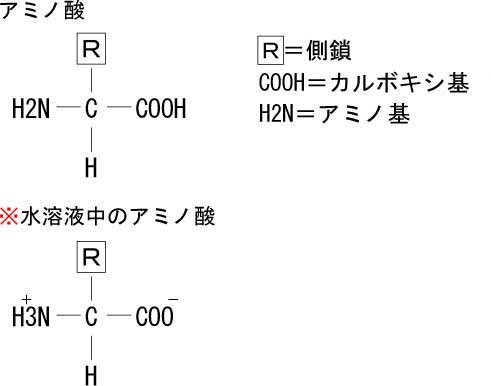
図のように、水溶液中では、アミノ基はプラスに帯電、カルボキシ基はマイナスに帯電する。
また側鎖の違いが、アミノ酸の種類の違いとなる。
ところで、アミノ酸からエネルギーが作られる時、アミノ基が切り離され、「アンモニア(NH3)になることがある。
これが尿素の形として排出されるのが、小便である。
アミノ酸の種類。アミノ酸配列。タンパク質一次構造
グリシン。アラニン。バリン。イソロイシン。セリン。トレオニン。システイン。メチオニン。アスパラギン酸。アスパラギン。グルタミン酸。グルタミン。アルギニン。リジン。ヒスチジン。フェニルアラニン。トリプトファン。プロリン。
タンパク質を構成するアミノ酸の種類は、基本的に上記の20種類とされている。
たいてい基本構造に、側鎖が違うだけだが、例外的にプロリンのみ、側鎖の一部がアミノ基と結合している。
タンパク質の性質は、アミノ酸の種類と量によって決まる。
アミノ酸のどの種類が、どういう順番で、どれだけ並んでいるか、という事を「アミノ酸配列」と言う。
アミノ酸配列は、タンパク質の「一次構造」と呼ばれる。
ペプチド結合。ポリペプチド
基本的に、アミノ酸は「ペプチド結合」という結合で結ばれている。
この結合は、二つのアミノ酸の、一方のアミノ基のHと、一方のカルボキシ基のHOが、水(H2O)として取れて、そこでくっつくというもの。
ペプチド結合によって、アミノ酸が繋がり、並んだ状態の一次構造を「ポリペプチド」、あるいは「ポリペプチド鎖」と言う。
ポリペプチドのパーツとしての、若干欠けたアミノ酸もどきは、アミノ酸残基と呼ばれる。
αヘリックス。βシート。タンパク質の第2構造
アミノ酸配列は、側鎖同士の、引きつけあったり、くっつきあったりする相互作用によって、部分的に形を変え、さらにそれらが全体の形として変わっていく。
そのようなアミノ酸配列の部分的に変形した形が、タンパク質の第2構造。
そして全体として、 結果的に定まった最終形が3次構造である。
よくある第2構造の形として、αヘリックスとβシートと呼ばれる形がある。
ヘリックスは、らせん状の形。
シートは板状の形である。
これらはたいていのアミノ酸配列の中に、一つ以上はほぼあるとされる、かなり基本的なもの。
また、βシートを形成する、一本一本規則正しく並ぶアミノ酸配列は、βストランドと呼ばれる。
αヘリックスやβシートは、あるアミノ酸の酸素原子と、別のアミノ酸の水素原子による、水素結合が基本となって形成される。
3次構造、リボンモデル。4次構造、サブユニット
ヘリックスやシートが絡み合ったような形である、タンパク質の3次構造の立体モデルは、リボンのような形に見える事から、「リボンモデル」と呼ばれる事もある。
ポリペプチドは、3次構造となって初めてタンパク質として機能する。
3次構造単体でも、タンパク質ではあるが、この3次構造がさらに集まることによって、集合体でありながら一個として働くタンパク質もある。
そのような3重構造の集合体を4次構造という。
また4次構造タンパク質を構成する部品となっている、単体においては3次構造であるタンパク質は、「サブユニット」と呼ばれる。
栄養学におけるタンパク質
なぜ肉を食べるか、なぜベジタリアンは危険か
進化の過程で、自らの体内で、全てのアミノ酸を作れなくなった生物は多い。
 「ダーウィン進化論」自然淘汰と生物多様性の謎。創造論との矛盾はあるか
「ダーウィン進化論」自然淘汰と生物多様性の謎。創造論との矛盾はあるか
我々、人間もそうである。
人は、20種類のアミノ酸の内、9種類しか体内で作ることができないとされている。
残りのアミノ酸は、外部から取り入れるしかない。
外部から摂取しなければ生きることすらできない、そのようなアミノ酸を「必須アミノ酸」と言う。
人の必須アミノ酸は、ロイシン、イソロイシン、リジン、メチオニン、フェニルアラニン、トレオニン、トリプトファン、パリン、ヒスチジンである。
食べ物としてのタンパク質において、上記のような必須アミノ酸の内、最も不足しているものを「第一制限アミノ酸」と言う。
そして、ある食べ物において、その第1制限アミノ酸の量をWHO(世界保健機関)などが定めたパーセント数値と比べたものを「アミノ酸価」と言い、栄養価の基準として使われている。
肉や卵などは、大抵アミノ酸価100とされる。
つまり必須アミノ酸を取得しなければならない我々が、肉を好きだというのは、かなり理にかなっている。
また完全なベジタリアンは危険行為である。
栄養素としてのアミノ酸。加熱による変性で減るか
我々が生肉を食べる事はそんなにない。
たいてい我々は食べる物をまず火にかける。
食べ物は、熱すると、「変性」する。
つまり色が変わったり形が変わったりする。
これは火の熱によって、タンパク質の4次構造や3次構造、時には2次構造まで破壊されているからであるが、1次構造は、普通破壊されない。
我々が栄養素として必要とするのは、アミノ酸であるから、原理的には、食べ物を火にかけたとしても、タンパク質構造が破壊されるだけで、栄養素まで破壊されるということはない。
火で炙ると、4次構造や3次構造が壊れてしまう事で、 言ってしまうなら、脆くなる。
このような、三次構造を破壊して、タンパク質を脆くするという変性は、胃袋内部で酸を使って行う方法と似ている。
これは食べ物を火で加熱し、タンパク質を変性させることによって、胃がその食べ物を消化しやすくなることを意味している。
食べ物を加熱するのは殺菌のイメージが強いが、このように消化をしやすくするという役割もある
本来なら、かなり消化の苦しいような食べ物も、事前に加熱する事により、普通に食べることができるようになるのである。
むしろ食べ物を、タンパク質を変性させずに食べるということは、そのタンパク質をそのまま体内に入れるということである。
普通はすぐに分解されるので問題ないが、しぶといタンパク質もいる。
他のタンパク質を破壊するような役割を持つ、タンパク質もある。
なので、我々がまさにそう願うように、タンパク質に含まれるアミノ酸のみを欲しい場合、先に火にかけるというのは、なかなか賢明である。
体内でアミノ酸はどのように使われてるのか
アミノ酸プール
我々の体内には、体外から取り込んだ必須アミノ酸以外にも、我々自身が作ったアミノ酸、それに自身のタンパク質を分解したアミノ酸と、いくつかの由来からなるアミノ酸がある。
それらの体内のあちこちにあるアミノ酸をまとめて、「アミノ酸プール」と言う。
このアミノ酸プールのアミノ酸を利用し、我々はタンパク質を合成する。
この貯蔵量は、ある程度一定に保たれるようで、過剰にアミノ酸を摂取したりすれば、それはそのまま代謝につかわれたり、排出されたりする。
フォールディングは意図的か。アンフィンゼンのドグマ
ポリペプチドは適切な形となって、初めてタンパク質として働くようになる。
しかし、体内で、いきなりタンパク質の形として、つまり第三次構造としてのポリペプチドが作られるわけではない。
まずは一次構造が作られ、二次構造、三次構造と変わっていく。
そうしたアミノ酸配列の一次構造が、二次構造になり、三次構造へと至る過程は「フォールディング」と呼ばれる。
だがこのフォールディングは、勝手に起こるものなのか、それとも何かの機能によって意図的に行われてるのかについては、古くから議論されていたという。
1960年代に、アメリカの生化学者アンフィンゼンが、あるタンパク質を変性させ、三次構造を壊して、一次構造にまでした。
それから変性させる為に用いた化学物質を取り除くと、どうなるかという実験を行った。
結果として、破壊された三次構造が復活するのが確かめられた。
アンフィンゼンの実験により、「タンパク質の高次構造は、アミノ酸配列が1次構造を成した時点で、すでに決まる」という説が有力となった。
この1次構造の段階で、高次構造までがもう決まっているという性質は、「アンフィンゼンのドグマ」と呼ばれる。
分子シャペロン。ストレスタンパク質
ところがアンフィンゼンのドグマは、必ずしも成り立たないということが、だんだんとわかってきた。
また、「分子シャペロン」、あるいは「シャペロンタンパク質」と呼ばれる、フォールディングを手助けするタンパク質も発見された。
シャペロンとはフランス語で「介添え役」という意味。
普通に考えて、アンフィンゼンのドグマが普遍的なものならば、もしくは、それを調節したりする必要がないなら、このようなものはいらないはず。
ショウジョウバエを使った研究で、熱によるショックを与えられた時に生じる「HSP(heat shock protein)」と呼ばれるタンパク質がある。
実は、このHSPがまさに分子シャペロンであったため、それの役割は、新しいタンパク質を作る、ではなく、おそらく作られるタンパク質がおかしくならないように、調整する役割なのではないかとも考えられる。
後にHSPは、熱以外にも、低酸素状態や、放射線を受けたり、有害物質にさらされたりした時にも発生することが判明し、調整役という可能性は高くなった。
HSPは、そういう訳で「ストレスタンパク質」とも呼ばれる。
 「ストレス」動物のネガティブシステム要素。緊張状態。頭痛。吐き気
「ストレス」動物のネガティブシステム要素。緊張状態。頭痛。吐き気
タンパク質の主な種類と役割
タンパク質が実際にどれくらいの種類あるのかは、正確にわかっていないが、個々のタンパク質が人体内で、どのような働きをするのかは、だいたいわかっている。
その役割によって、タンパク質は、以下のように7つに分類できる。
1酵素タンパク質(生体内で、何らかの効果を発揮する化学反応を引き起こすタンパク質)
2構造タンパク質(そのまま、体の各部位の構成部品としてのタンパク質)
3貯蔵タンパク質(栄養源などを貯蔵するタンパク質)
4収縮タンパク質(筋肉の収縮などを引き起こすタンパク質)
5防御タンパク質(抗体として。免疫反応に関わりを持つタンパク質)
 「アレルギー」なぜ起きるのか?なぜ増えたのか?発症のメカニズム
「アレルギー」なぜ起きるのか?なぜ増えたのか?発症のメカニズム
6調節タンパク質(生体内で発生する何らかの効果などを調整したりする役割を持つタンパク質)
7輸送タンパク質(酵素などを運ぶタンパク質)





いつも楽しく読んでます。
この記事で「カルボキシル基」と表記されていますが、生物の授業では「カルボキシ基」として習ったのですが、どちらが正しい表記なのでしょうか?
カルボキシ基の方がわりと普通(というか標準)。
英語じゃカルボキシ基単体を指す場合「carboxy group」だからと思います。
つまりcarboxyはカルボキシルよりカルボキシの方が近い読み方だからと思われます。
つまりごめんなさい。
カルボキシ基が正しいです。
表記をまったく気にしておりませんでした。